Por que as nanopartículas se agregam?
1. Mecanismo impulsionado pela energia livre superficial
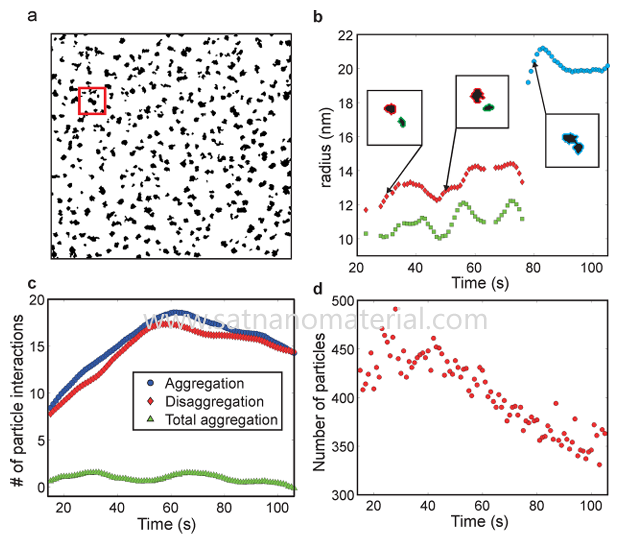
As nanopartículas possuem uma área superficial específica maior e átomos superficiais insaturados, o que leva a um aumento na energia livre superficial. O contato entre múltiplas partículas pode reduzir a área superficial total, liberar energia interfacial e, assim, diminuir a energia livre do sistema. Essa tendência de minimização de energia é a força motriz termodinâmica intrínseca por trás da aglomeração espontânea de partículas e é uma fonte comum de aglomeração na nanoescala.
2. Eletricidade estática e instabilidade da dupla camada elétrica
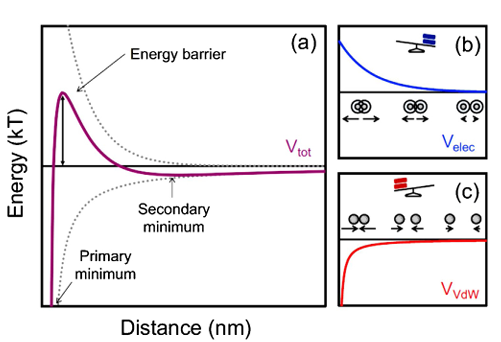
A dupla camada elétrica formada por partículas carregadas pode proporcionar um estado de dispersão estável de repulsão eletrostática. Quando o pH se aproxima do ponto isoelétrico ou a força iônica aumenta, a bicamada é comprimida, a força repulsiva diminui e a energia potencial atrativa entre as partículas torna-se dominante, levando à aglomeração. A estabilidade dessa barreira de potencial determina a capacidade antiagregação do sistema.
3. A influência da ação do meio solvente
Partículas em solução dependem da camada de solvatação para alcançar estabilidade interfacial. Se o solvente tiver baixa polaridade e pouca afinidade, torna-se difícil formar uma camada de solvatação eficaz, o que aumenta o contato direto entre as partículas, intensifica as forças de van der Waals e desencadeia a aglomeração. Portanto, as propriedades físico-químicas dos solventes afetam diretamente o estado de dispersão das partículas.
4. Modo de agregação por ligação química
Partículas com alta reatividade podem formar aglomerados estáveis por meio de ligações de hidrogênio, coordenação ou ligações covalentes de grupos funcionais, como hidroxila e carboxila, em suas superfícies. Essa ligação química torna a agregação irreversível e difícil de dissociar fisicamente. Esse processo se baseia na reatividade química dos estados de energia da superfície e dos grupos funcionais.
Por que as nanopartículas são dispersas?
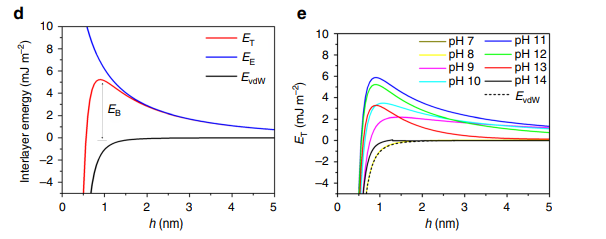
1. Estabelecer uma barreira de energia potencial por meio de repulsão eletrostática.
A carga superficial das partículas forma uma estrutura de dupla camada elétrica no líquido e, quando duas partículas se aproximam, gera-se repulsão eletrostática entre as duplas camadas. Esse efeito repulsivo cria uma barreira de energia potencial entre as partículas, suprimindo efetivamente a agregação causada pela atração de curto alcance. Se houver uma barreira de potencial suficientemente alta na energia potencial total do sistema, as partículas encontram-se em um estado dinamicamente estável. Esse mecanismo depende da densidade de carga, da constante dielétrica e da força iônica, e constitui uma base estável comum para coloides aquosos.
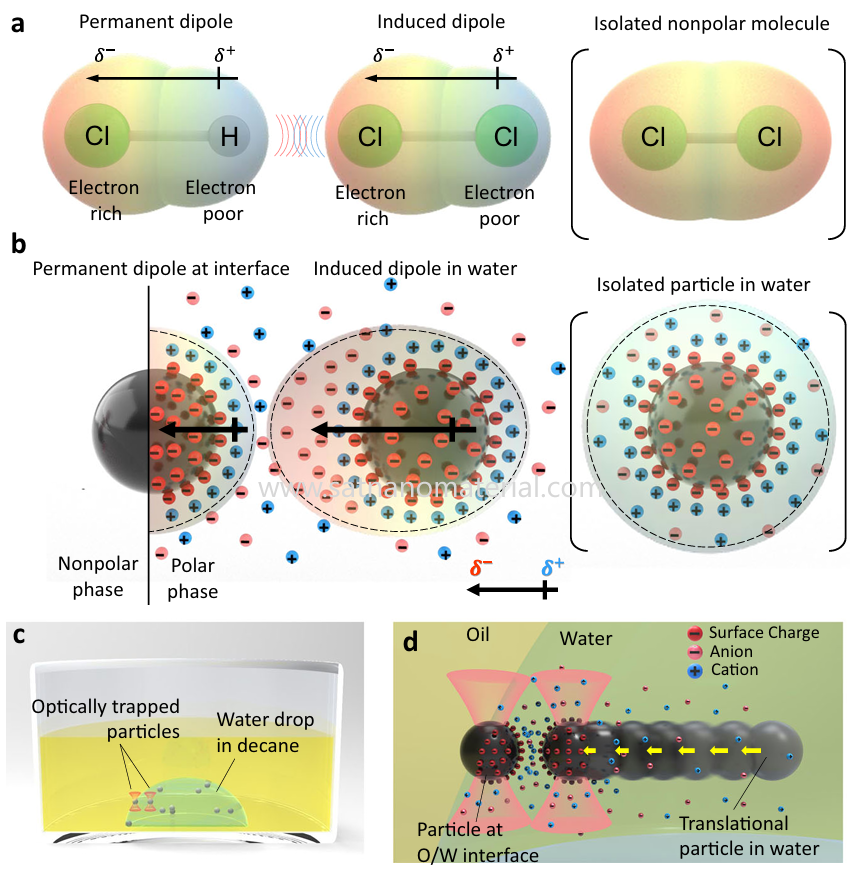
2. Intervalo de aprimoramento do efeito de impedimento estérico espacial
O efeito de impedimento estérico é gerado pela adsorção ou enxertia de segmentos de polímero na superfície das partículas. Quando as partículas tendem a se aproximar, essas estruturas moleculares geram forças de compressão conformacional e repulsão, impedindo o contato entre elas.
Esse mecanismo não depende da carga superficial e é adequado para sistemas com alta força iônica ou não polares. O impedimento espacial fornece uma barreira física e é um dos mecanismos de dispersão mais comuns em sistemas revestidos por polímeros ou surfactantes, particularmente evidente em partículas com superfície modificada.
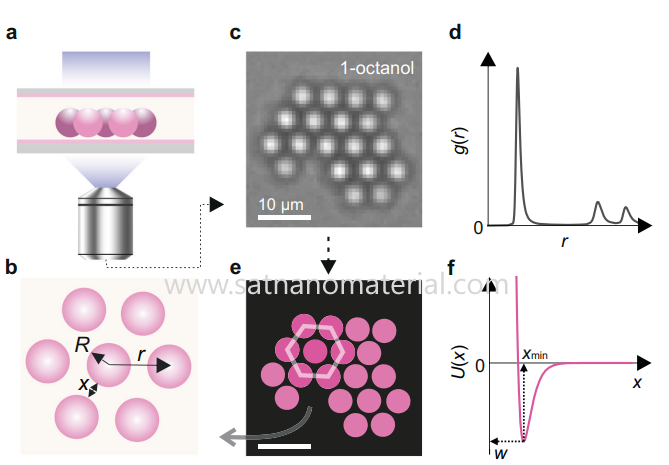
3. A camada de solubilização impede o contato.
Quando as partículas formam uma camada de solvatação estável com as moléculas do solvente, essa camada oferece barreiras de energia significativas quando as partículas se aproximam, impedindo o contato direto entre elas. A espessura e a estabilidade da camada de solvatação dependem da polaridade, da capacidade de formação de ligações de hidrogênio e da afinidade do solvente com a superfície da partícula. Se o contato entre as partículas exigir a superação da energia de dessorção da camada de solvatação, essa barreira de energia pode reduzir efetivamente a probabilidade de aglomeração e constitui um importante mecanismo de garantia de dispersão em condições de não repulsão elétrica.
4. A funcionalização da superfície aumenta a estabilidade química.
A funcionalização de superfícies pode introduzir carga, estrutura espacial ou fatores reguladores hidrofóbicos para aumentar a repulsão entre partículas ou melhorar a compatibilidade interfacial, aprimorando assim a estabilidade da dispersão. Ao enxertar ligantes, cadeias poliméricas ou grupos funcionais, a superfície pode alcançar um mecanismo duplo de repulsão elétrica e proteção espacial, dificultando a aproximação das partículas e a formação de agregados. Esse método é amplamente utilizado em sistemas como óxidos metálicos e pontos quânticos, e é uma das principais estratégias para se obter dispersão controlável.
A SAT NANO é uma das melhores fornecedoras de nanopós e micropós na China, e podemos fornecer... pó metálico , pó de liga , pó de óxido e pó de carboneto Se tiver alguma dúvida, entre em contato conosco pelo endereço admin@satnano.com.
 serviço on-line
serviço on-line 13929258449
13929258449 admin@satnano.com
admin@satnano.com + 8613929258449
+ 8613929258449